Реакции в виде озноба, боли в ротоглотке, тошноты: что указано в инструкции к вакцине "Спутник V"
Опубликовано:

С 1 февраля в Казахстане стартовала массовая вакцинация от коронавируса – прививать людей начали российской вакциной «Спутник V». В первые дни вакцинации журналисты NUR.KZ попросили медиков показать нам вакцину и полную аннотацию препарата, чтобы изучить всю описанную там информацию.
"Не трясти": точное название вакцины и требования к хранению
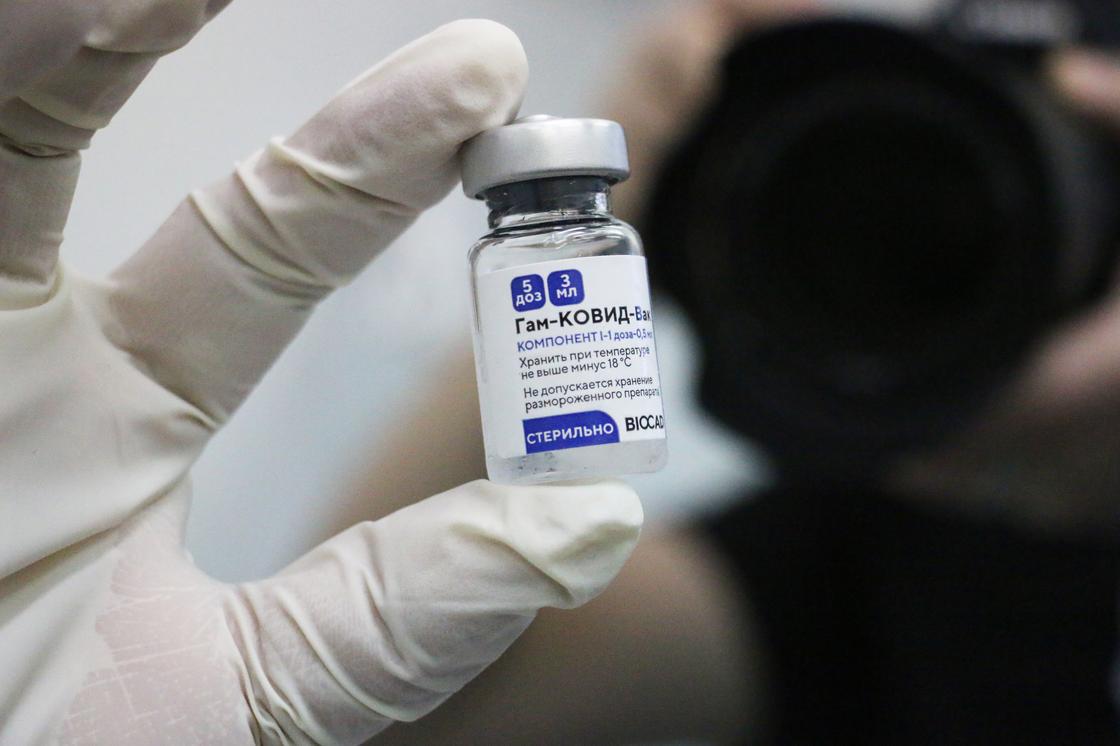
На упаковке вакцины указано название «Гам-КОВИД-Вак» - комбинированная векторная вакцина для профилактики коронавирусной инфекции, вызываемой вирусом Sars-CoV-2 (новой коронавирусной инфекции Covid-19).
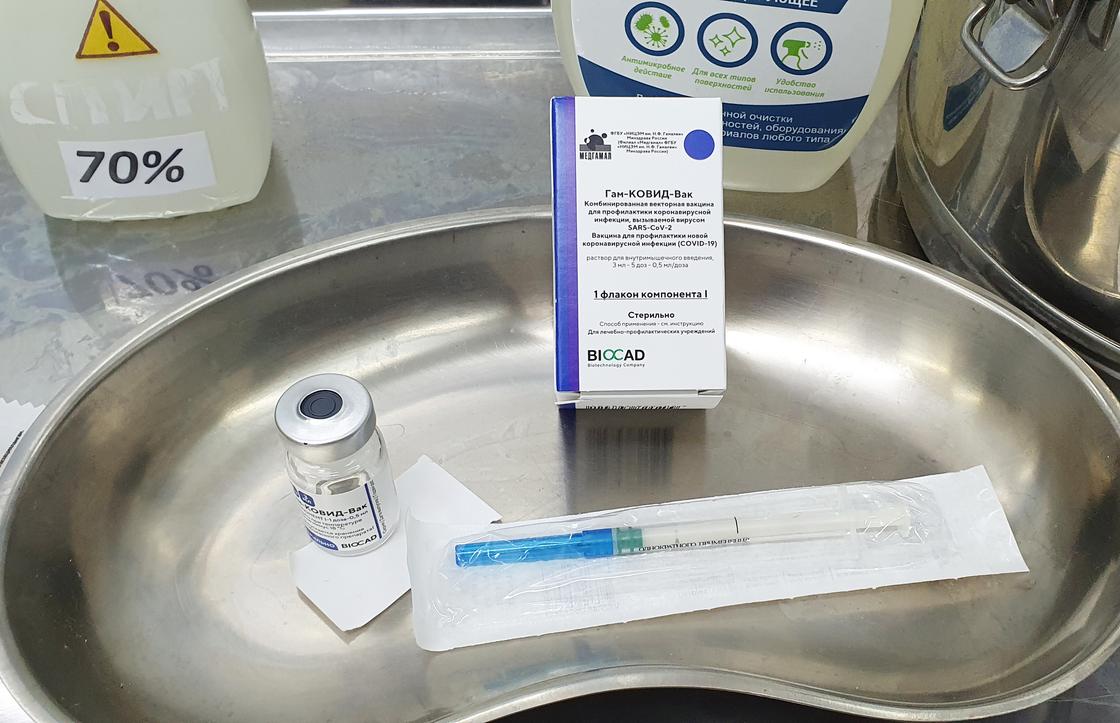
Мы сфотографировали упаковку и флакон компонента 1 – это первая «часть» вакцины, компонент 2 вводится пациенту через 21 день.
Вводят строго внутримышечно в верхнюю треть плеча либо латеральную широкую мышцу бедра – введение в вену строго запрещено.

При нас флакон достали из холодильника, он был заморожен – медик должен дождаться его полной разморозки при комнатной температуре.
Остаток включений льда не допускается, трясти флакон запрещено – перемешивать содержимое можно только «покачиванием».
Температура хранения - не выше минус 18-ти градусов.
Производитель: АО "ГЕНЕРИУМ", Россия, Владимирская область.
Привить 5 человек за 2 часа
Во флаконе 3 мл вещества – это 5 доз по 0,5 мл.
После разморозки хранить флакон можно не более 2-х часов – повторная заморозка запрещена. Это значит, что в течение 2-х часов медик должен привить 5 человек либо утилизировать остатки препарата.
Состав вакцины – компонент 1 и компонент 2
Действующее вещество компонента 1: рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S вируса SARS-CoV-2.
Действующее вещество компонента 2: рекомбинантный аденовирусный вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-CoV-2.
Вспомогательные вещества обоих компонентов: трис (гидроксиметил), аминометан, натрия хлорид, сахароза, полисорбат 80, магния хлорида гексагидрат, ЭДТА динатриевая соль дигидрат, этанол 95%, вода для инъекций.

Первые строки в инструкции к вакцине гласят:
"Данный препарат зарегистрирован по процедуре регистрации препаратов для применения в условиях угрозы возникновения, возникновения и ликвидации ЧС.
Инструкция подготовлена на основании ограниченного объема клинических данных и будет дополняться по мере поступления новых данных".
Противопоказания
- гиперчувствительность к какому-либо компоненту вакцины или вакцины, содержащей аналогичные компоненты,
- тяжелые аллергические реакции в анамнезе,
- острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний – вакцинацию проводят через 2-4 недели после выздоровления или ремиссии. При нетяжелых ОРВИ, острых инфекционных заболеваниях ЖКТ – вакцинацию проводят после нормализации температуры,
- беременность и период грудного вскармливания,
- возраст до 18-ти лет (в связи с отсутствием данных об эффективности и безопасности),
Противопоказания для введения компонента 2: тяжелые поствакцинальные осложнения (анафилактический шок, тяжелые генерализованные аллергические реакции, судорожный синдром, температура 40 градусов и т.д) на введение компонента 1.
Препарат применять с осторожностью при:
- хронические заболевания печени и почек,
- эндокринные заболевания (нарушение функции щитовидной железы и сахарный диабет в стадии декомпенсации),
- тяжелые заболевания системы кроветворения,
- эпилепсии и другие заболевания ЦНС,
- острый коронарный синдром и острое нарушение мозгового кровообращения,
- миокардит, эндокардит, перикардит.
Вследствие недостатка информации вакцинация может представлять риск для следующих групп населения:
- с аутоиммунными заболеваниями (стимуляция иммунной системы может привести к обострению заболевания, особенно следует с осторожностью относиться к пациентам с аутоиммунной патологией, имеющей тенденцию к развитию тяжелых и жизнеугрожающих состояний),
- со злокачественными новообразованиями.
Принятие решения о вакцинации должно основываться на оценке соотношения пользы и риска в каждой конкретной ситуации.
Взаимодействие с другими препаратами – исследования не проводились.
Особенности влияния на управление транспортным средством – исследования не проводились.

Нежелательные реакции на вакцину
Нежелательные реакции могут развиваться в первые-вторые сутки после вакцинации и разрешаются в течение 3-х последующих дней.
Часто: непродолжительный гриппоподобный синдром с ознобом, повышением температуры тела, артралгией, миалгией, астенией, общим недомоганием, головной болью.
Также боль в ротоглотке, заложенность носа, першение в горле, ринорея, тошнота, рвота, снижение аппетита, диспепсия.
Местные реакции в виде болезненности в месте введения, с гиперемией, отечностью, зудом.
Иногда: увеличение регионарных лимфоузлов, у некоторых возможны аллергия, кратковременные повышение уровня печеночных трансаминаз, креатинина и креатинфосфокиназы в сыворотке крови.
Редко: головокружения и обмороки.
Организация, принимающая претензии по качеству лекарственных средств, а также ответственная за пострегистрационное наблюдение за безопасностью вакцины в Казахстане - Карагандинский фармацевтический комплекс.


Оригинал статьи: https://www.nur.kz/health/coronavirus/1896951-reakcii-v-vide-oznoba-boli-v-rotoglotke-tosnoty-cto-ukazano-v-instrukcii-k-vakcine-sputnik-v/
Как вам публикация?
Последние комментарии
Всего комментариев: 29
Чтобы участвовать в обсуждении или оставлять реакции на комментарии, войдите в профиль.
Данной вакциной уже заинтересовались и Франция и Германия.Где то читал что температуру хранения повысили до минус 8-10 градусов.
aA1234
После прививки, это не значить, что вы не заболеете.Она не даёт 100 процентов гарантии, также, те кто сделал прививку от гриппа, им переболели.
Konisbay8
Бақылау шаралары жасалынып отырады ол сөзсіз
Kuandik40
Салатын адамдардан қателік кетпейді деп сенеміз
Bolat45
Үлгіні бастан шығармаулары керек дәрігерлер
Azamat34
Ешқандай зияны жоқ деп санаймын егер барлыған осы нұсқамен жасайтын болса
Garipull19
Бәрі оңынан болар деп сенеміз енді
Mukat47
Дәрігерлердің өзі толық танысып барып қолданады уайымдамаңыздар
Danijar34
Әрине осының бәрін ескертіп қою керек дәрігерлерге
Sunkar40
Жарайсыздар толық бақылап қате кетпейуін қадағаласаңыздар болғаны енді
Sagi51
Барлығын бақылап отырғандары көрініп ақ тұр
kyat
Меніңше зиян ештеңесі жоқ,бәрі сол айтылғанмен істелсе болдығой
Asan85
Толығымен контрольда болса болғаны бастысы
Zhanibek0
Жарайсыздар осылай толық барлығы тексеріліп отырғандары дұрыс
Askarbek53
Өз ісіне жауапты қарайтын қарайтын секілді меніңше зиян болмас ешқандай
zhaudyr
Начало массовой вакцинации положено, все проводят на высшем уровне. Главные санврачи уже привились и чувствуют себя хорошо
Nursat74
Вакцинацияланған орындар мен вакцина өндірушілер үшін бәрі жауапты, сондықтан алаңдамаңыз. Кенеттен дәрігермен байланысу керек
Hurshida51
Барлығы егілуі керек, әсіресе мемлекет барлық шығындарды өз мойнына алды. Барлығы алдымен дәрігермен кеңесу керек
Esbol65
Жарайсыңдар, барлығы осылай Мұқият көрсетті, мен жаппай вакцинация арқылы ғана коронавирусты жеңе аламыз деп сенемін
Serkkali38
Все под ответственность места где вакцинируют и производителей вакцины, так что не переживайте. Вдруг что нужно связаться с врачом
здравый
производители вакцины уже ответили,что никакой ответственности не будут нести,вакцина не прошла все стадии испытании...
Daulet54
Всем нужно прививаться, тем более государство взяло все расходы на себя. Всем нужно проконсультироваться с врачом в первую очередь
Isatay23
Молодцы, все так досконально показали, верю что только через массовую вакцинацию мы сможем победить коронавирус
aA1234
Мы её не победим, мы с короной будем жить и каждый год будем прививаться, это тоже самое, как от гриппа. Думаю, что с каждым годом корона будет мутировать и ослабевать. И будет она стоять наравне с гриппом. Будем прививаться от гриппа, короны и что от нас останется.
JonDoe
Отличная приписка "возраст до 18-ти лет (в связи с отсутствием данных об эффективности и безопасности)" Делая выводы можно понять не эффективна на и не безопасна.То есть взрослым ставят, если что случится то хроническая болезнь повлияла напишут потом.
Мыслитель
епрст, по моему можно самому тупо все что есть в аптеке выпить,и получить такую же побочку, это же совсем уже, я не буду вакцину ставить пока не заболею,вот буду лежать умирать и задыхаться,тогда да, тогда вколю, а так ни за какие ковришки и кьюар коды не пойду получать эту ядерную бомбу для организма!
Toreto
вы видимо не одну инструкцию не читали к лекарствам... у простейшего парацетомола и то больше побочек... а у антибиотиков вообще на 2 листа одни побочки..
Темиржан
чтоб вирусов не укачало
кеша
ясно! зная наших не по детски жадных до всего и шибко предприимчивых специалистов, при чём любого профиля - нас ещё и возможно будут щпынять неутилизированными остатками, слитой со многих флаконов, вакцины...

котофей